Last Updated on 24 พฤศจิกายน 2022 by siamroommate
กรดซัลฟูริก (Sulfuric acid) หรือ กรดกำมะถัน มีสูตรเป็น H2SO4 จัดเป็นกรดแก่อนินทรีย์ ไม่มีสี มีกลิ่นฉุน ถูกใช้ประโยชน์ในอุตสาหกรรมต่างๆอย่างหลากหลาย ทั้งการเป็นตัวเร่งปฏิกิริยา สารให้ประจุ สารปรับสภาพความเป็นกรด และใช้เป็นส่วนผสมในผลิตภัณฑ์ทำความสะอาด เป็นต้น แต่จัดเป็นสารที่ก่อให้เกิดพิษรุนแรงทั้งในสถานะไอระเหย และสารละลาย
คุณสมบัติเฉพาะ [1], [2]
• สูตรเคมี (Chemical Formula) : H2SO4
• ชื่อทางเคมี (Chemical Name) : Sulfuric acid
• ชื่ออื่นๆ(Synonyms) :
– เอสิด มิสต์ (Sulfuric Mist)
– ไฮโดรเจนซัลเฟต (Hydrogen Sulfate)
– ซัลเฟอร์ เอสิด (Sulfur acid)
– ซัลฟูริก เอสิด (Sulfuric acid)
– สเปนต์ (Spent)
• น้ำหนักโมเลกุล (Molecular Weight) : 98.08 กรัม/โมล
• ลักษณะทางกายภาพ (physical properties) : ของเหลว ไม่มีสี ไม่มีกลิ่น และสามารถอยู่ในรูปของแข็ง และก๊าซได้
• จุดเดือด (Boiling point) : 337 องศาเซลเซียส
• จุดหลอมเหลว (Melting point) : 10.31 องศาเซลเซียส
• ความถ่วงจำเพาะ (specific gravity, SG) : 1.84 กรัม/ลบ.ซม.
• ความหนาแน่น (Density) : 1.8302 (กรัม/มล. ที่ 20 องศาเซลเซียส)
• ความหนืด (Viscosity) : 24.2 เซนติพอยส์ (cp) (โดยเปรียบเทียบกับเอทานอล (ethanol) ที่ 1.1 cp หรือ กลีเซอรอล (glycerol) ที่ 934 cp)
• ความหนาแน่นไอ (Vapor Density) : 3.4
• ความดันไอ (Vapor pressure) : 5.93X10-5 มิลลิเมตรปรอท (25 องศาเซลเซียส)
• ความเป็นกรด (pH) : ความเข้มข้น 1 N เท่ากับ 0.3, 0.1 N เท่ากับ 1.2 และ 0.01 N เท่ากับ 2.1
• จุดวาบไฟ (Flash point) : ไม่มี
• การละลาย (Solubility) : ละลายได้ดีในน้ำ
• สารที่ต้องหลีกเลี่ยง (Materials to Avoid) : สารละลายด่างแก่ น้ำ เซลลูโลส และโลหะต่างๆ
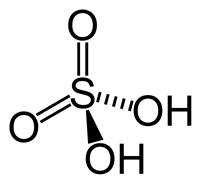
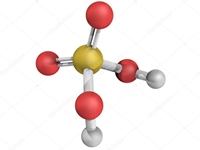
กรดไนตริก เป็นกรดของซัลเฟอร์ออกไซด์ มีสูตรทางเคมีเป็น H2SO4 ประกอบด้วยอะตอมตรงกลางที่เป็นซัลเฟอร์ (S) และถูกล้อมรอบ และจับกับหมู่ไฮดรอกซิล (OH–) 2 หมู่ และอะตอมของออกซิเจน (O) อีก 2 อะตอม

 |
 |
การผลิตกรดซัลฟูริก [1], [2]
เนื่องจากกรดซัลฟูริกจัดเป็นกรดแก่ สามารถผลิตที่ความเข้มข้นได้สูงถึง ความเข้มข้นโดยทั่วไป 93-99%
โดยสามารถผลิตได้ 3 วิธี ตามวัตถุดิบที่ใช้ ได้แก่
1. การผลิตจากการเผากำมะถัน
• ขั้นตอนที่ 1 เริ่มด้วยการหลอมกำมะถัน (S) ให้เป็นของเหลว จากนั้น สูบฉีดให้เป็นฝอยในห้องเผาไหม้ พร้อมเผาไหม้จนได้เป็นก๊าซซัลเฟอร์ไดออกไซด์ (SO2) ดังสมการ
S (ของแข็ง) + ความร้อน = S (ของเหลว)
S (ของเหลว) + O2 (ออกซิเจน) + ความร้อน = SO2 (ก๊าซ)
• ขั้นที่ 2 ดูดก๊าซซัลเฟอร์ไดออกไซด์ (SO2) เข้าทำปฏิกิริยากับออกซิเจน (O2) จนได้เป็นก๊าซซัลเฟอร์ไตรออกไซด์ (SO3) ดังสมการ
SO2 (ก๊าซ) + O2 (ออกซิเจน) = SO3 (ก๊าซ)
• ขั้นที่ 3 การนำซัลเฟอร์ไตออกไซด์ (SO3) เข้าทำปฏิกิริยากับน้ำจนได้กรดซัลฟูริก (H2SO4)
SO3 (ก๊าซ) + H2O (น้ำ) = H2SO4 (ของเหลว)
2. การผลิตจากแร่ที่มีองค์ประกอบกำมะถัน
วิธีนี้จะใช้สายแร่ที่มีองค์ประกอบของกำมะถันมาเป็น เช่น แร่เพอไรต์ (FeS2) แร่สังกะสีซัลไฟต์ (ZnS) และแร่คาลโคไซด์ (chalcocite: Cu2S) เป็นต้น
• ขั้นที่ 1 เริ่มต้นด้วยการเผาก้อนแร่ เช่น แร่สังกะสีซัลไฟต์ ( ZnS) เพื่อให้ได้ก๊าซซัลเฟอร์ไดออกไซด์ (SO2)
ZnS + O2 (ออกซิเจน) + ความร้อน = ZnO (ของแข็ง) + SO2 (ก๊าซ)
• จากนั้น จะนำก๊าซซัลเฟอร์ไดออกไซด์ (SO2) เข้าสู่ขั้นตอนที่ 2 และ 3 ดังแสดงในวิธีการผลิตที่ 1 ต่อไป
3. การผลิตจากก๊าซที่มีองค์ประกอบของกำมะถัน
วิธีนี้ จะใช้ก๊าซซัลเฟอร์ไดออกไซด์ (SO2) เป็นวัตถุดิบขั้นต้นในการผลิต ซึ่งมักเป็นก๊าซที่เป็นผลพลอยได้หรือก๊าซปล่อยทิ้งจากกระบวนการผลิตผลิตภัณฑ์หลัก โดยมีขั้นตอนหลักเริ่มตั้งแต่ขั้นตอนที่ 2 ตามวิธีการผลิตที่1
ปฏิกิริยากรดซัลฟูริก
1. กรดซัลฟูริกเมื่อละลายน้ำจะทำให้สารละลายมีค่าความเป็นกรดของสารละลายเพิ่มขึ้นจาก H3O+ ดังสมการ
H2SO4 + H2O = HSO4– + H3O+
2. กรดซัลฟูริกเมื่อละลายน้ำจะทำให้สารละลายเกิดความร้อน ดังสมการ
89%H2SO4 + H2O = x%HSO3– + H3O+ + Energy
ทั้งนี้ ความร้อนที่เกิดขึ้นจะมีค่าความร้อนสูง และขึ้นอยู่กับความเข้มข้นของกรดด้วย โดยอาจเกิดความร้อนสูงจนทำให้สารละลายเดือดได้
3. กรดซัลฟูริกเมื่อสัมผัสกับโลหะ เช่น เหล็ก (Fe ) จะทำให้เกิดก๊าซไฮโดรเจน (H2) และเกลือของโลหะชนิดนั้น เช่น เกลือของเหล็ก (FeSO4) ดังสมการ
H2SO4 + Fe = FeSO4 + H2
4. กรดซัลฟูริกเมื่อสัมผัสกับอโลหะ เช่น คาร์บอน (C) จะทำให้เกิดออกไซด์ของธาตุนั้น เช่น คาร์บอนไดออกไซด์ (CO2) ร่วมกับก๊าซซัลเฟอร์ไดออกไซด์ (SO2) ที่มีความเป็นพิษสูง ดังสมการ
H2SO4 + C = CO2 + 2(SO2) + 2(H2O)

วิธีนำกรดซัลฟูริกกลับมาใช้ใหม่ [3]
1. วิธีตกผลึก
โดยมีขั้นตอน คือ ลดอุณหภูมิของสารละลายกรดที่ใช้แล้วเหลือ5 oC แล้วแยกเอาผลึกเกลือของ FeSO47H2O ออกโดยการเหวี่ยง (screen centifuge) ซึ่งผลที่ได้ คือ กรดซัลฟูริกที่นำมาใช้ใหม่ได้ และเกลือเขียว (FeSO4) โดยวิธีนี้ มีข้อดี คือ นำกรดอิสระมาได้กว่า 80 % การสะเทินต้องการด่างน้อยกว่า และลดตะกอนยิปซั่ม แต่มีข้อเสีย คือ เงินลงทุนสูง มีสารตกค้างเช่นเกลือของเหล็กซัลเฟต และต้องใช้งานที่ความเข้มข้นของ Fe มากกว่า 60 g/l และความเข้มข้นของ H2SO4 มากกว่า 150 g/l ถึงจะคุ้มค่า
2. วิธีแลกเปลี่ยนอิออนกรด(H+)
โดยมีขั้นตอน คือ ทำการดูดซับอิออนอิสระของกรดโดยใช้เรซิน โดยการผ่าน FeCl2 และ FeSO4 แล้วนำอิออนของกรดอิสระกลับมาโดยทำปฏิกิริยากับน้ำ ซึ่งผลที่ได้ คือ กรดซัลฟูริกที่นำมาใช้ใหม่ได้, ของเสียในรูปของ FeCl2 และ FeCl4 โดยวิธีนี้ มีข้อดี คือ เงินลงทุนต่ำ ขนาดปานกลาง ค่าซ่อมบำรุงต่ำ ประหยัดพื้นที่ และสามารถนำกรดอิสระกลับมาได้กว่า 80 % แต่มีข้อเสีย คือ สารตกค้าง: เหล็กคลอไรด์, ใช้ไปแต่ละครั้ง ประสิทธิภาพในการนำกรดกลับมาลดลง
การใช้ประโยชน์กรดซัลฟูริก/กรดกำมะถัน
1. ภาคอุตสาหกรรม
– ใช้เป็นตัวเร่งปฏิกิริยาในกระบวนการผลิตของอุตสาหกรรมต่างๆ เช่น อุตสาหกรรมปิโตรเคมี และพลาสติก เป็นต้น
– ใช้เป็นตัวทำละลาย, ใช้สำหรับการรักษาพื้นผิวโลหะ, ใช้เป็นสารชุบแข็ง, ใช้เป็นสารยับยั้งการกัดกร่อน, ใช้เป็นสารขัดเงา, ใช้เป็นสารยับยั้งการเกิดสนิม และสารกันน้ำ เป็นต้น
– ใช้ในกระบวนการผลิตผลิตภัณฑ์ต่างๆ อาทิ ปุ๋ย สารเคมีทางการเกษตร กรดชนิดต่างๆ สารส้ม และเส้นใย เป็นต้น
– ใช้ผลิตแบตเตอรี่สำหรับยานยนต์เพื่อทำหน้าที่ทำให้เกิดให้ประจุไฟฟ้า
– ใช้ในกระบวนการสกัดสินแร่ต่างๆ อาทิ สังกะสี และทองคำ เป็นต้น
– ใช้เป็นส่วนผสมของผลิตภัณฑ์ทำความสะอาด
2. ภาคการเกษตร
– ใช้เป็นสารละลายเจือจงสำหรับทำความสะอาดผลิตภัณฑ์ทางการเกษตร
– ใช้สำหรับกำจัดน้ำออกจากเนื้อไม้หรือผลิตภัณฑ์ทางการเกษตรเพื่อทำให้แห้ง
– ใช้สำหรับทำให้น้ำยางพาราจับก้อนเป็นก้อนยาง แต่คุณภาพก้อนยางจะมีค่อยดีนัก ก้อนยางยุ่ยง่าย ยางมีความยืดหยุ่นน้อย แต่เกษตรมักใช้เพราะราคาถูกกว่ากรดชนิดอื่น
3. การนำไปใช้ประโยชน์ด้านอื่นๆ
– ใช้เป็นสารปรับสภาพความเป็นกรดด่างในระบบบำบัดน้ำเสีย
– ใช้เป็นสารปรับสภาพความเป็นกรดด่างในระบบผลิตน้ำประปา
– ใช้ในห้องปฏิบัติการสำหรับปรับสภาพความเป็นกรดด่างของสารละลายต่างๆ

ความเป็นพิษกรดซัลฟูริก/กรดกำมะถัน [1], [2]
ตามประกาศกรมโรงงานอุตสาหกรรม ออกตามพระราชบัญญัติวัตถุอันตราย พ.ศ. 2535 เรื่องบัญชีรายชื่อวัตถุอันตราย พ.ศ. 2556 ประกาศให้กรดซัลฟูริกที่มีความเข้มข้นมากกว่าร้อยละ 50 โดยน้ำหนัก (> 50% w/w) จัดเป็นวัตถุอันตรายประเภทที่ 3 หากมีการผลิต การนำเข้า การส่งออก และการครอบครอง ต้องได้รับอนุญาตจากกรมโรงงานอุตสาหกรรมเสียก่อน ทั้งนี้ ค่าความเข้มข้นต่ำสุดที่สามารถรับกลิ่นได้ที่ 1.0 มิลลิกรัม/ลูกบาศก์เมตร และมีความเป็นพิษต่อสุขภาพดังนี้
1. การสัมผัส
– การสัมผัสกรดซัลฟูริกเข้มข้นบริเวณผิวหนังจะทำให้ผิวหนังเกิดอาการระคายเคืองอย่างรุนแรง ผิวหนังไหม้เป็นแผลผุพอง เกิดอาการปวดแสบปวดร้อนอย่างรุนแรง แต่หากเป็นกรดที่มีความเข้มข้นน้อยก็จะแสดงอาการระคายเคืองไม่รุนแรง เกิดอาการผื่นแดง และมีอาการแสบร้อนร่วมด้วย
– การสัมผัสกับตา ทั้งสารละลายกรดหรือไอระเหย หากเป็นกรดซัลฟูริกเข้มข้นจะทำให้ดวงตาบอดได้ แต่หากเป็นกรดที่เข้มข้นน้อยจะทำให้เกิดการระคายเคือง และอาการปวดแสบปวดร้อนร่วมด้วย
2. การสูดดม
การสูดดมไอระเหยของกรดซัลฟูริกหรือก๊าซพิษซัลเฟอร์ไดออกไซด์ที่เกิดปฏิกิริยากรดซัลฟูริกกับวัสดุต่างๆ จะทำให้เยื่อบุในระบบทางเดินหายใจระคายเคืองอย่างรุนแรง เกิดอาการปวดแสบปวดร้อนบริเวณโพรงจมูก หลอดลม และภายในปอด เนื่องจากมีการอักเสบเกิดขึ้น ร่วมกับอาการแน่นหน้าอก หายใจลำบาก อาจเกิดอาการช็อก และภาวะขาดออกซิเจนจนทำให้เสียชีวิตตามมาได้
3. การดื่มกิน
การดื่มกินกรดซัลฟูริกเข้มข้นเพียง 2-3 หยด อาจทำให้เสียชีวิตได้ เนื่องจากกรดซัลฟูริกเข้มข้นสามารถกัดเยื่อบุในระบบทางเดินอาหารให้ทะลุได้ ทั้งบริเวณช่องปาก หลอดลม กระเพาะอาหาร และลำไส้ จนทำให้มีเลือดออกภายในอวัยวะ เกิดสภาวะโลหิตเป็นกรด และระบบไหลเวียนโลหิตไม่ทำงานจนเป็นสาเหตุทำให้เสียชีวิต
ข้อปฏิบัติ
1. ขณะใช้งาน ให้สวมอุปกรณ์ป้องกันอันตรายจากสารเคมีทุกครั้ง
2. ห้ามเทน้ำลงในกรดที่มีความเข้มข้นสูง ข้อปฏิบัติให้เป็นเทกรดลงน้ำ เพราะหากเทน้ำลงกรดจะทำให้เกิดเกิดปฏิกิริยาออกซิไดซ์อย่างรุนแรง เกิดการฟุ้งกระเด็นของน้ำกรดที่อาจเป็นอันตรายต่อร่างกายได้
3. การใช้งาน ควรใช้งานในตู้ดูดอากาศเป็นหลัก
4. เมื่อเกิดควันพิษของกรด ผู้ปฏิบัติงานต้องออกจากสถานที่ทันที
5. ห้ามสัมผัสโดยตรงโดยไม่สวมใส่ชุดหรืออุปกรณ์ป้องกันสารเคมี และเมื่อสัมผัสกับสารละลายกรด ให้รีบล้างออกด้วยน้ำสะอาดทันที
6. ห้ามดื่มกิน เพราะอาจทำให้เสียชีวิตได้

การเก็บรักษา
1. เก็บในภาชนะที่ทนต่อการกัดกร่อนได้ เช่น ขวดแก้ว หรือ ขวดพลาสติกชนิดทนกรด
2. เก็บในสถานที่หรืออาคารที่มีการระบายอากาศได้ดี แสงแดดส่งไม่ถึง
3. เก็บให้ห่างจากโลหะทุกชนิด น้ำ และสารละลายที่เป็นด่าง
4. เก็บให้ห่างจากแหล่งความร้อน หรือเปลวไฟ
5. ติดป้ายกำกับ ป้ายเตือน ข้อห้าม และข้อมูลจำเพาะไว้ในสถานที่จัดเก็บ
เอกสารอ้างอิง
[1] U.S. National Library of Medicine. ออนไลน์. เข้าถึงได้ที่ : https://pubchem.ncbi.nlm.nih.gov/compound/Sulfuric-acid/.
[2] SULFURIC ACID, ACS REAGENT. ออนไลน์. เข้าถึงได้ที่ : https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/1/s1526pis.pdf/.
[3] อาทร วุฒิสัตย์วงศ์กุล. 2545. การปรับปรุงกระบวนการนำกลับกรดไฮโดรคลอริก-
จากน้ำกรดกำจัดสนิมเหล็กด้วยวิธีการแลกเปลี่ยนอิออน.







