Last Updated on 24 พฤศจิกายน 2022 by siamroommate
กรดไนตริก (Nitric acid) หรือ กรดดินประสิว จัดเป็นกรดแก่อนินทรีย์ มีลักษณะเป็นของเหลวใส ไม่มีสี ถูกใช้ประโยชน์ในอุตสาหกรรมหลายประเภท อาทิ สิ่งทอ สีย้อม สารทำความสะอาด ปุ๋ย สารเคมีทางการเกษตร และวัตถุระเบิด เป็นต้น ทั้งนี้ หากสูดดมสารชนิดนี้เป็นเวลานานอาจทำให้เกิดหลอดลม และปอดอักเสบเรื้อรังได้
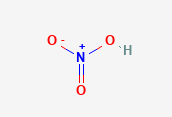
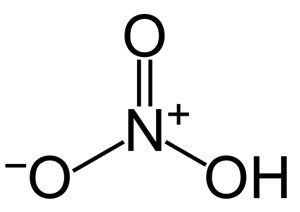
กรดไนตริก เป็นกรดของไนโตรเจนออกไซด์ มีสูตรทางเคมีเป็น HNO3 ประกอบด้วยอะตอมไนโตรเจนที่จับกับกลุ่มไฮดรอกซี (OH-) และอะตอมของออกซิเจน (O) อีก 2 อะตอม
คุณสมบัติเฉพาะ[1]
• ลักษณะทางกายภาพ (physical properties) : มีสถานะเป็นของเหลวใส ไม่มีสี ไม่มีกลิ่น
• สูตรทางเคมี (Chemical Formula) : HNO3
• น้ำหนักโมเลกุล (Molecular Weight) : 63.013 กรัม/โมล
• จุดเยือกแข็ง (freezing point) : -42 องศาเซลเซียส
• จุดหลอมเหลว (Melting point) : 83 องศาเซลเซียส
• การละลาย (Solubility) : ละลายได้ดีในน้ำ และแอลกอฮอล์
• ความดันไอ (Vapor pressure) : 48 มิลลิเมตรปรอท (30 องศาเซลเซียส)
• ความหนาแน่นไอ (Vapor Density) : 2-3
• ความหนาแน่น (Density) : 1.5129 (กรัม/มล. ที่ 20 องศาเซลเซียส)
• สารที่ต้องหลีกเลี่ยง (Materials to Avoid) : สารประกอบเซลลูโลส ด่าง โลหะต่างๆ
ทั้งนี้ ความหนาแน่น และความดันไอของกรดไนตริกจะมากหรือน้อย ขึ้นอยู่กับความเข้มข้นของไนโตรเจนไดออกไซด์ที่มีอยู่

 |
 |
การผลิตกรดไนตริก [1]
กรดไนตริกที่ผลิตขึ้นในปัจจุบันเกือบทั้งหมดจะผลิตได้จากกระบวนการออกซิเดชันของแอมโนเนียกับอากาศจนเกิดเป็นไนโตรเจนไดออกไซด์ (NO2) จากนั้น นำไนโตรเจนไดออกไซด์ (NO2) ไปทำปฏิกิริยากับน้ำจนได้เป็นผลิตภัณฑ์กรดไนตริก ดังสมการ
สมการที่ 1 โดยใช้แอมโมเนียเป็นสารตั้งต้นสำหรับทำปฏิกิริยากับอากาศหรือออกซิเจน
• 4NH3+7O2 = 4NO2 + 6H2O (สมการ 1)
สมการที่ 2-5 เป็นการผลิตกรดไนตริก โดยใช้ไนโตรเจนไดออกไซด์ (NO2) ทำปฏิกิริยากับน้ำ
• 4NO2 + 2H2O + O2 = 4HNO3 (สมการ 2) หรือ
• 2NO2 + H2O = HNO3 + HNO2 (สมการ 3) หรือ
• 3HNO2 = HNO3 + 2N + H2O (สมการ 4) หรือ
• 3NO2 + H2O = 2HNO3 + NO (สมการ 5)
ขั้นตอนการผลิตกรดไนตริกเรียกว่า กระบวนการ กระบวนการ Ostwald แบ่งออกเป็น 3 ขั้นตอนหลัก ได้แก่
1. การเร่งปฏิกิริยาออกซิเดชันของแอมโมเนียด้วยออกซิเจนในบรรยากาศเพื่อให้ได้ไนโตรเจนมอนออกไซด์ (NO)
2. การออกซิเดชั่นไนโตรเจนมอนออกไซด์เพื่อให้ได้ไนโตรเจนไดออกไซด์ (NO2)
3. การทำปฏิกิริยาระหว่างไนโตรเจนไดออกไซด์ (NO2) กับ น้ำ เพื่อให้ได้กรดไนตริก (HNO3)
ประโยชน์กรดไนตริก [1]
กรดไนตริกที่มีจำหน่ายตามท้องตลาดมีระดับความเข้มข้นที่แตกต่างกัน โดยมีการผลิตออกมาในรูปกรดไนตริกเข้มข้นสูงสุดที่ความเข้มข้น 70% โดยถูกนำไปใช้ประโยชน์ในด้านต่างๆ ดังนี้
1. ด้านอุตสาหกรรม
– ใช้เป็นสารตัวเร่งปฏิกิริยา ใช้เป็นตัวทำละลายโลหะ อาทิ มีการใช้กรดไนตริกเป็นตัวทำละลายโลหะในเหมืองทองคำ หรือ ใช้เป็นตัวทำละลายในอุตสาหกรรมผลิตภัณฑ์ไฟฟ้า และอิเล็กทรอนิกส์
– ใช้เป็นส่วนผสมของผลิตภัณฑ์ทำความสะอาดต่างๆ อาทิ ผลิตภัณฑ์ล้างจาน สบู่, สารชะล้าง, น้ำยาปรับผ้านุ่ม เป็นต้น รวมถึงใช้เป็นสารทำความสะอาดโดยตรง โดยเฉพาะการทำความสะอาดโลหะในภาคอุตสาหกรรม
– ใช้เป็นส่วนผสมของผลิตภัณฑ์ต่างๆเพื่อช่วยต้านการเกิดโฟม ช่วยให้สารจับเป็นเนื้อเดียวกันได้ดี ช่วยในการกระจายตัวของส่วนผสม ช่วยให้เกิดฟอง และช่วยปรับสภาพความหนืด เป็นต้น
– ใช้ในอุตสาหกรรมสิ่งทอ และฟอกหนัง
– ใช้ในอุตสาหกรรมผลิตสี และสารเคลือบ
– ใช้ในระบบบำบัดน้ำเสีย เพื่อปรับสภาพความเป็นกรด-ด่าง
– ใช้ในกระบวนการผลิตบุหรี่หรือผลิตภัณฑ์ที่เกี่ยวข้องกับบุหรี่
2. ด้านการเกษตร ใช้เป็นส่วนผสมของผลิตภัณฑ์สำหรับป้องกัน และกำจัดเชื้อราในทางการเกษตร
3. ในครัวเรือน ถูกใช้สำหรับการฆ่าเชื้อโดยตรง อาทิ ใช้ทำความสะอาดโลหะหรือเครื่องเรือน และใช้ทำความสะอาดพืชผลทางการเกษตร เพื่อการฆ่าเชื้อโรค และป้องกันเชื้อรา ทั้งนี้ จะใช้ในลักษณะสารละลายเจือจาง และมีการล้างทำความสะอาดอีกรอบด้วยน้ำสะอาด
4. ห้องปฏิบัติการ ใช้กรดไนตริกสำหรับการเตรียมสารละลาย และการปรับสภาพความเป็นกรด-ด่างของสารละลาย รวมถึงใช้ปรับความเป็นกรดของตัวอย่างคุณภาพน้ำ เพื่อช่วยป้องกันการตกตะกอนของโลหะหนักหรือการเกาะติดของโลหะหนักกับภาชนะ รวมถึงป้องกันการเติบโตของจุลินทรีย์
5. ในทางการแพทย์ พบการใช้กรดไนตริกสำหรับการรักษาหูด ใช้เป็นตัวทำละลายในทางเภสัชกรรม และใช้เป็นส่วนผสมของยาฆ่าเชื้อ เป็นต้น นอกจากนี้ ยังพบรายงานการศึกษาที่ทดลองนำสารละลายของกรดไนตริก หรือที่เรียกว่า Solcoderm solution มารักษาเนื้องอกบริเวณผิวหนังชั้นนอก ซึ่งพบว่า ผลการรักษามีการตอบสนองต่อสารละลายกรดไนตริกได้เป็นอย่างดี
6. ทางทหาร กรดไนตริกถูกใช้เป็นสารตั้งต้นในการผลิตวัตถุระเบิด
ข้อมูลความปลอดภัย
1. เมื่อละลายในน้ำ โมเลกุลจะแตกตัวให้ไฮโดรเจนไอออน (H+) ทำให้สารละลายมีฤทธิ์เป็นกรด
2. มีฤทธิ์กัดกร่อนโลหะ และวัสดุที่ทำจากเซลลูโลส
3. หากสัมผัสกับวัสดุที่มีเซลลูโลสจะทำให้เกิดควันของสารจำพวกออกไซด์ที่เป็นพิษ และมีโอกาสลุกติดไฟได้เอง
4. สามารถสลายตัว และระเหยได้ง่าย โดยเฉพาะเมื่อทำปฏิกิริยากับโลหะจะทำให้เกิดไอระเหยของไฮโดรเจน และไนโตรเจนไดออกไซด์ ซึ่งมีลักษณะเป็นควันน้ำตาลสีแดง
5. ภาชนะบรรจุ หากได้รับความร้อนอาจทำให้ระเบิดได้

ความเป็นพิษของกรดไนตริก
1. การสูดดม
– หากสูดดมไอระเหยของกรดไนตริกเข้าไป ไอระเหยของกรดไนตริกจะทำให้เกิดการระคายเคืองต่อเนื้อเยื่อในระบบทางเดินหายใจทันที อาการที่เกิดขึ้น ได้แก่ แสบจมูก แสบลำคอ แสบ และแน่นหน้าอก
– หากสูดดมไอระเหยของกรดไนตริกเป็นเวลานานอาจทำให้เกิดหลอดลม และปอดอักเสบเรื้อรังได้
2. การสัมผัส
– การสัมผัสกับผิวหนังจะทำให้เกิดการระคายเคือง เกิดอาการปวดแสบปวดร้อน และผิวหนังอักเสบ และเป็นแผลได้
– การสัมผัสกับตา หากความเข้มข้นน้อยจะทำให้เกิดการระคายเคือง มีอาการแสบตา แต่หากมีความเข้มข้นสูงอาจทำให้ดวงตาอักเสบ และถึงกับตาปอดได้
3. การนำเข้าสู่ร่างกาย (ดื่ม)
ห้ามดื่มกินกรดไนตริกเข้าสู่ร่างกาย จะทำให้เกิดการระคายเครื่องต่อเยื่อบุทางเดินอาหารอย่างรุนแรง โดยเฉพาะกรดไนตริกเข้มข้น โดยจะเกิดอาการปวดแสบปวดร้อนทั้งบริเวณช่องปาก ลำคอ และกระเพาะอาหาร อาจทำให้เยื่อบุทุกส่วนในระบบทางเดินอาหารเป็นแผล และทะลุ มีเลือดออก อาเจียนเป็นเลือด และเกิดอาการช๊อคได้
ข้อปฏิบัติ
1. การปฏิบัติงานหรือการใช้กรดไนตริกทุกครั้งต้องสวมชุดหรืออุปกรณ์ป้องกันสารเคมี ได้แก่ ชุดป้องกันสารเคมี หน้ากากกันสารเคมี แว่นตากันสารเคมี ถุงมือที่ทนต่อกรด และรองเท้าบูท
2. การใช้กรดไนตริกในห้องปฏิบัติการ ควรใช้ภายในตู้ดูดอากาศ
3. ผู้ใช้งานต้องมีความรู้หรือความเข้าใจเกี่ยวกับข้อมูลต่างๆของกรดไนตริก
4. เมื่อมีการสัมผัสบริเวณผิวหนังหรือดวงตา ให้รีบล้างออกด้วยน้ำสะอาดทันที ทั้งนี้ หากผู้ได้รับสารเกิดอาการอักเสบที่รุนแรงให้รีบพบแพทย์ทันที
5. เมื่อเกิดไอระเหยที่รุนแรงให้รีบออกจากแหล่งกำเนิดทันที และหากมีการสูดดมจนเกิดอาการปวดแสบภายในระบบหายใจที่รุนแรงให้รีบนำส่งแพทย์ทันที
การจัดเก็บ
– เก็บในภาชนะที่เป็นแก้วชนิดสีชา
– แยกเก็บหรือเก็บให้ห่างสารประกอบเซลลูโลส น้ำ สารที่เป็นด่าง และโลหะต่างๆ
– เก็บในอาคาร ห่างจากแสงแดดส่องถึง และมีการระบายอากาศดี
– เก็บให้ห่างจากแหล่งความร้อน และเปลวไฟเย็น
– เก็บให้ห่างจากวัตถุระเบิด สารออกซิไดซ์ และสารที่ปล่อยรังสี
– พื้นที่จัดเก็บควรมีป้ายกำกับ ป้ายเตือน ข้อห้าม และมีข้อมูลความปลอดภัยที่สามารถอ่านได้ และชัดเจน
เอกสารอ้างอิง
[1] U.S. National Library of Medicine. เข้าถึงได้ที่ https://pubchem.ncbi.nlm.nih.gov/compound/Nitric-acid







