Last Updated on 23 พฤศจิกายน 2022 by siamroommate
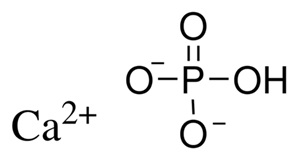
แคลเซียมฟอสเฟต (Calcium phosphate) เป็นสารประกอบหรือแร่ธาตุที่มีแคลเซียมไอออน (Ca2+) และฟอสเฟตไอออนเป็นองค์ประกอบอนินทรีย์ มีลักษณะเป็นผลึกหรือผงสีขาว จัดเป็นแร่ธาตุที่มีคุณค่าทางโภชนาการ พบได้ในสิ่งมีชีวิต พบในส่วนของกระดูก และฟัน พบในเลือด ในน้ำนม พบในรูปคอลลอยด์ในกล้ามเนื้อที่ยึดจับกับเคซีน ที่เรียกว่า แคลเซียมฟอสเฟตคอลลอยด์ (CCP) โดยแคลเซียมฟอสเฟตที่มีการผลิต และถูกใช้ประโยชน์อย่างมาก ได้แก่ ไฮดรอกซีแอปาไทต์
ไฮดรอกซีแอปาไทต์ มาจากคำว่า ไฮดรอกซี (hydroxy) ซึ่งหมายถึง ไฮดรอกไซต์ไอออน(hydroxide- ion) และคำว่า แอปาไทต์ (apatite) ซึ่งเป็นชื่อของผลึกแร่ธาตุที่มีองค์ประกอบเป็น M10(ZO4)6X2 ไฮดรอกซี-แอปาไทต์มีสูตรทางเคมีคือ Ca10(PO4)6(OH)2 มีอัตราส่วนโดยโมลของ Ca/Pเป็น 1.67
คุณสมบัติเฉพาะ เพิ่มเติมจาก [1], [2]
• CAS Number : 7758-87-4
• ชื่อทางการค้า (Trade Name) : แคลเซียมฟอสเฟต (Calcium phosphate)
• ชื่อทางเคมี (Chemical Name) : Calcium phosphate
• สูตรทางเคมี (Chemical Formula) :
– Ca5(PO4)3·OH
– Ca4(PO3)2
– Ca3(PO4)2
– Ca3O8P2
• น้ำหนักโมเลกุล (Molecular Weight) : 310.2 กรัม/โมล
• ลักษณะทางกายภาพ (physical properties) : ผงสีขาว ไม่มีกลิ่น มีรสจืด
• ความหนาแน่น (Density) : 3.14 กรัม/มล. (ที่ 20 °C)
• การละลาย (Solubility) : ละลายน้ำได้ 25 mg/L ที่ 25°C

สารประกอบของแคลเซียมฟอตเฟตชนิดต่าง ๆ
สารประกอบจำพวกแคลเซียมฟอสเฟต นอกจากไฮดรอกซีแอปาไทต์ที่นำมาใช้ในงานด้านวัสดุชีวภาพแล้ว ยังมีสารประกอบของแคลเซียมฟอตเฟตชนิดอื่นๆ สารประกอบเหล่านี้มีความแตกต่างกันที่อัตราส่วนโดยโมลของ Ca/P และชนิดของไอออนองค์ประกอบ
| สูตรทางเคมี | ชื่อทางเคมี หรือ การค้า | อักษรย่อ | สัดส่วน Ca/P |
| Ca4O(PO4)2
Ca10(PO4)6(OH)2 Ca10-xH2x(PO4)6(OH)2 Ca3(PO4)2 Ca8H2(PO4)6.5H2O CaHPO4.2H2O CaHPO4 Ca2P2O7 Ca2P2O7.2H2O Ca7(P5O16)2 Ca4H2P5O20 Ca(H2PO4)2.H2O Ca(PO3)2 |
Tetracalcium phosphate (Hilgenstockite)
Hydroxyapatite Amorphous calcium phosphate Tricalcium phosphate (α , β ,γ) Octacalcium phosphate Dicalcium phosphate dihydrate (Brushite) Dicalcium phosphate (Monetite) Calcium pyrophosphate (α, β, γ) Calcium pyrophosphate dihydrate Heptacalcium phosphate (TrÖmelite) Tetracalcium dihydrogen phosphate Monocalcium phosphate monohydrate Calcium metaphosphate (α, β, γ) |
TeCp
HA ACP TCP OCP DCPD DCP CPP CPPD HCP TDHP MCPM CMP |
2.0
1.67 1.50 1.33 1.0 1.0 1.0 1.0 0.7 0.67 0.5 0.5 |
การผลิตแคลเซียมฟอสเฟต
ปัจจุบันการผลิตแคลเซียมฟอสเฟตนิยมใช้วิธีการสังเคราะห์เป็นหลัก เพราะสามารถผลิตได้จำนวนมากในเวลาอันรวดเร็ว โดยมีวิธีผลิตหลากหลายวิธี ได้แก่
1. ปฏิกิริยาที่สภาวะของแข็ง (solid-state reaction)
วิธีปฏิกิริยาที่สภาวะของแข็งเป็นวิธีการพื้นฐาน โดยให้สารเคมีในสภาวะของแข็งมาทำปฏิกิริยากันที่อุณหภูมิสูง เช่น การทำปฏิกิริยาระหว่างโมโนแคลเซียมฟอสเฟตโมโนไฮเดรต (Ca(HPO4)2.H2O กับแคลเซียมคาร์บอเนต (CaCO3) ใช้เวลาประมาณ 3 ชั่วโมง ที่อุณหภูมิ 1200 oC พร้อมด้วยอากาศที่มีไอน้ำ (H2O) และไนโตรเจน (N2) ดังสมการ
3Ca(HPO4)2.H2O + 7CaCO3 = Ca10(PO4)6(OH)2 + 8H2O + 7CO2
1200 oC/3 hrs และ (H2O + N)
ในขั้นสุดท้ายจะได้ผลิตภัณฑ์เป็นไฮดรอกซีแอปาไทต์ที่มีลักษณะเป็นผงละเอียดสีขาว และมีการเรียงตัวของโครงสร้างผลึกที่ดี
2. การตกตะกอนร่วมทางเคมี (chemical Precipitation)
วิธีตกตะกอนร่วมทางเคมีจะอาศัยหลักการการตกตะกอน โดยใช้สารใช้ตกตะกอน (precipitating agent) เข้าปฏิกิริยาที่สภาวะที่เหมาะสม ซึ่งวิธีการนี้ จะใช้เกลือของแคลเซียมมาทำปฏิกิริยากับเกลือฟอตเฟตเป็นหลักภายใต้การควบคุมสภาวะต่าง ๆที่เหมาะสม เช่น อุณหภูมิ และความเป็นกรด-ด่างเข้มข้นที่ pH 3 ดังสมการ
5Ca(NO3)2 + 3(NH4)3PO4 + NH4OH = Ca5(OH)(PO4)3 + 10NH4NO3
ทั้งนี้ การใช้เกลือฟอสเฟตสามารถใช้ได้หลายชนิด ได้แก่ CaCO3, Ca(OAC)2, CaCl2 และCa(NO3) เป็นต้น ส่วนสารตั้งต้นของฟอสเฟตก็สามารถใช้ได้หลายชนิด เช่น (NH4)2HPO4, KH2PO4, K2HPO4, NaH2PO4 Na2HPO4 และ(NH4)3PO4 เป็นต้น ดังสมการ
10Ca(OH)2 + 6H3PO4 = Ca10(PO4)6(OH)2 + 18H18O
ในขั้นสุดท้ายจะได้ผลิตภัณฑ์เป็นไฮไฮดรอกซีแอปาไทต์ หรือ แคลเซียมฟอสเฟตที่มีลักษณะเป็นผงสีขาว แต่การเรียงตัวของโครงสร้างผลึกยังไม่ดีเท่าวิธีการแรกนัก
3. วิธีโซลเจล (sol- gel method)
วิธีโซลเจลจะเริ่มจากการใช้สารตั้งต้นของสารประกอบอัลคอกไซด์ (alkoxide) สำหรับเป็นตัวทำละลายที่ ซึ่งส่วนใหญ่จะใช้เป็นแอลกอฮอล์เป็นหลัก จากนั้น นำสารประกอบอัลคอกไซด์ (alkoxide) เข้าทำปฏิกิริยาไฮโดรไลซิส (hydrolysis) และปฏิกิริยาการรวมตัว (condensation) ดังสมการ
M-(OR)x + xH2O = M-(OH)x + xR-OH (hydrolysis)
M-OH + HO-M = M-OM + H2O (water condensation)
M-OR + HO-M = M-OM + R-OH (alcohol condensation)
M หมายถึง โลหะที่มีเลขวาเลนซีเท่ากับ x
R หมายถึง หมู่อัลคิล (alkyl) หรือ เอริล (aryl)
วิธีโซลเจลจะมีปฏิกิริยาเกิดขึ้นอย่างต่อเนื่อง ทำให้เกิดเป็นสารที่มีโมเลกุลขนาดใหญ่ขึ้น (oligomers) เกิดกิ่งก้านสาขา (brarching) และเกิดการเชื่อมโยง (crosslinking) เป็นโครงสร้างสามมิติจนได้สารที่มีลักษณะเป็นโซล (sol) และ เจล (gel) ตามลำดับ สำหรับไฮดรอกซีแอปาไทต์ด้วยวิธีโซลเจลจะมีลักษณะของผลึกเป็นผงละเอียด มีความบริสุทธ์สูง และโครงสร้างผลึกที่ค่อนข้างสมบูรณ์ วิธีนี้บางครั้งอาจเรียกว่า วิธีอัลคอกซ์ไซด์ (alkoxide method) ซึ่งใช้ในการสังเคราะห์ไฮดรอกซีแอปาไทต์ให้มีลักษณะเป็นฟิล์มบางๆ โดยใช้แคลเซียมไนเตรตตระไฮเดรตกับไตรเมทิลฟอสเฟตในเอทานอลหรือฟอร์มาไมด์ ปล่อยให้ตัวทำละลายระเหยไปบางส่วน และเผาที่อุณหภูมิ 500 – 1000 oC ดังสมการ
Ca(NO3)2.4H2O + (CH3O)3PO = Ca10(PO4)6(OH)2
เมื่อสิ้นสุดปฏิกิริยาจะได้ผลึกไฮดรอกซีแอปาไทต์ที่มีลักษณะรูปผลึกที่สมบูรณ์
4. วิธีไฮโดรเทอร์มัล (hydrothermal method)
วิธีไฮโดรเทอร์มัลเริ่มด้วยการนำเกลือขแคลเซียม และฟอตเฟตชนิดต่างๆ มาทำปฏิกิริยาภายใต้สภาวะที่มีความดัน และอุณหภูมิสูง อาทิ การใช้ Ca(NO3)2 เข้าทำปฏิกิริยากับ KH2PO4 ร่วมกับ NaOH ที่อุณหภูมิ 500 oC ภายใต้ความดัน 360 บรรยากาศ เป็นเวลานาน 10 วัน ดังสมการ
10Ca(NO3)2 + 6KH2PO4 + 14NaOH = Ca10(PO4) 6(OH)2+6KNO3+14NaNO3+ 12H2O
500 oC 360 atm ที่ 10 วัน
นอกจากนี้ ยังมีการใช้วิธีไฮโดรเทอร์มอลในการเปลี่ยนโครงสร้างปะการัง (coral) ซึ่งมี CaCO3 เป็นองค์ประกอบหลักมีโครงร่างผลึกเป็น aragonite ให้เป็นไฮดรอกซีแอปาไทต์โดยยังให้คงรูปร่างเป็นหินปะการังที่มีรูพรุนอยู่ โดยทำการเผาหินปะการังที่ 250 oC และความดัน 15000 psi ดังสมการ
10CaCO3 + 6(NH4)HPO4 + 2H2O = Ca10(PO4) 6(OH)2 + 6(NH4)CO3 + 4H2O + 4CO2
500 oC 360 atm ที่ 10 วัน
5. วิธีฟลักซ์ (flux method)
วิธีฟลักซ์ ทำการสังเคราะห์ไฮดรอกซีแอปาไทต์ชนิดที่เป็นผลึกเดี่ยวที่มีขนาดใหญ่ซึ่งทำได้โดยนำไฮดรอกซีแอปาไทต์และแคลเซียมออกไซด์ (CaO) มาผสมกับฟลักซ์ เช่น B2O3 แล้วนำไปเผาที่อุณหภูมิสูงถึง 1200 oC ในแฟลตินัมครูซิเบิล โดยควบคุมเวลา และอัตราการเย็นตัวต่าง ๆ กัน ผลึกของไฮดรอกซีแอปาไทต์ที่ได้จะมีลักษณะเป็นรูปเข็ม (needle – shaped apatite) ขนาดยาว 11 มม. หนา 0.31 มม. แต่เป็นผลึก ไฮดรอกซีแอปาไทต์ชนิดที่มีโบรอนอยู่ด้วย
การใช้ประโยชน์แคลเซียมฟอสเฟต
1. กระบวนการผลิตในภาคอุตสาหกรรม ได้แก่
– แคลเซียมฟอสเฟตถูกใช้ในการผลิตปุ๋ยฟอสเฟต เซรามิกส์ และกรดฟอสฟอริก
2. ทางด้านอาหาร
– แคลเซียมฟอสเฟต ถูกใช้เป็นผลิตภัณฑ์อาหารเสริมเพื่อเพิ่มแคลเซียมให้แก่ร่างกาย
3. ทางด้านการเกษตร
– แคลเซียมฟอสเฟต ถูกผลิตเป็นปุ๋ยทางการเกษตรในสูตรต่างๆ เพื่อใช้สำหรับพืชในการให้ธาตุอาหารฟอสฟอรัส และแคลเซียม

4. ทางด้านการแพทย์
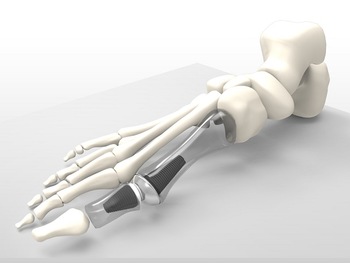
– แคลเซียมฟอสเฟต ถูกใช้ผลิตเป็นเซรามิกส์ในงานด้านการแพทย์ อาทิ ทางด้านออร์โทปิดิกส์ งานทันตกรรม เช่น ฟันเทียม การผลิตกระดูกเทียม ข้อต่อกระดูกเทียม และอื่นๆ
– แคลเซียมฟอสเฟต ถูกใช้สำต้านการดูดซึมธาตุกำมันตรังสีในระบบทางเดินอาหาร เช่น เรเดียม (Ra-226) และสตรอนเทียม (Sr-90)
เอกสารอ้างอิง
[1] U.S. National Library of Medicine. Calcium phosphate. ออนไลน์. สืบค้นเมื่อวันที่ 5 มิถุนายน 2563. เข้าถึงได้ที่ : https://pubchem.ncbi.nlm.nih.gov/compound/Calcium-phosphate/.
[2] wikipedia.org. Calcium phosphate. ออนไลน์. สืบค้นเมื่อวันที่ 4 มิถุนายน 2563.. เข้าถึงได้ที่ : https://en.wikipedia.org/wiki/Calcium_phosphate/.







